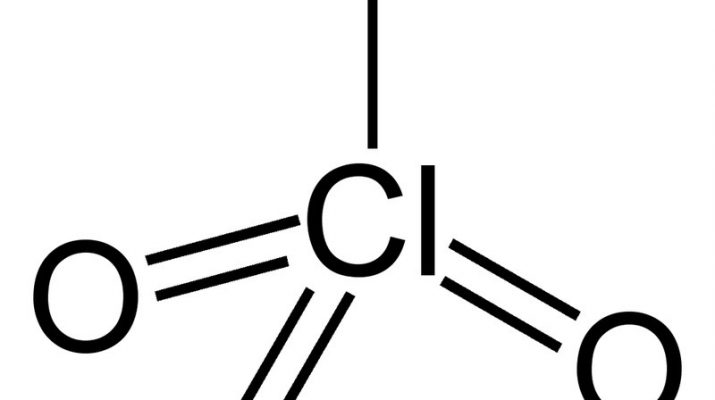
El ácido perclórico es una solución incolora e inodora. Se trata de un compuesto considerado un ácido fuerte comparable en fuerza al sulfúrico y los ácidos nítricos, así como un poderoso agente oxidante, de ahí que sean múltiples los productos con ácido perclórico
Uno de sus usos más frecuentes es para preparar sales de perclorato, sobre todo las de perclorato de amonio.
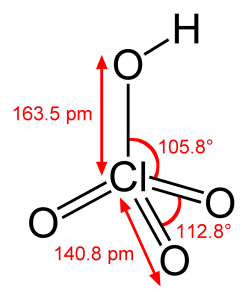
Características del ácido perclórico
El ácido perclórico es capaz de formar azeotrópico al mezclarse con agua, componente que abarca alrededor del 72,5% de ácido perclórico.
Se trata de una forma de ácido que es estable indefinidamente, por lo cual está disponible a nivel comercial. Cabe destacar que tales soluciones se caracterizan por ser higroscópicas. De manera que si se dejan abiertas al aire, el ácido perclórico concentrado se diluirá al absorber agua del aire.
Grado de pureza
Esta es una solución acuosa al 70% de grado de reactivo ACS con una pureza mínima del 98%.
Antecedentes
Como se dijo al principio, es uno de los ácidos más fuertes que se conocen. Su pKa es de -10. Proporciona una fuerte acidez sin interferencias de potenciales nucleófilos como el sulfato o el cloruro que complican el uso de sulfúricos y ácidos clorhídricos.
Además, cuenta con la ventaja de que a diferencia de otros ácidos de aniones no coordinados, como pueden ser el ácido hexafluorofosfórico y el ácido flurobórico, que son susceptibles a la hidrólisis, éste no lo es.
Aplicaciones
Pese a que sus sales son peligrosas y propensas a explosiones, se trata de un ácido con una gran cantidad de aplicaciones e incluso favoritismos para algunas síntesis.
Para empezar hay que decir que es eluyente bastante útil, pero también es utilizado en el electropulido y grabado de algunos metales como el molibdeno, aluminio, entre otros.
Seguridad
Aunque los ácidos perclóricos anhidros y monohidratados son explosivos, las acuosas soluciones como ésta son estables en ausencia de compuestos orgánicos. De hecho, es muy corrosivo para la piel y los ojos. Materiales como la tela y la madera se encienden al entrar en contacto con el ácido perclórico concentrado, orgánico.
Las sales de ácido perclórico también son poderosas oxidantes que pueden ser explosivas. Las sales de perclorato tienden a ser más estables que sus contrapartes del clorato, lo que ha llevado a su mayor uso en composiciones pirotécnicas por motivos de seguridad.
Debido a estos peligros, el ácido perclórico se suele manipular bajo las campanas de gases con lavado y depuración de aire, que no están disponibles en el laboratorio estándar campanas de humo.